นับตั้งแต่การระบาดของโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 หรือโควิด-19 (Coronavirus Disease 2019 — COVID-19) อุบัติขึ้นที่เมืองอู่ฮั่น มณฑลเหอเป่ยของจีน ในช่วงปลายปี 2019 ที่ผ่านมา และแพร่กระจายไป 213 ประเทศและเขตปกครองทั่วโลก
การติดเชื้อในหลายประเทศรุนแรงจนเกินกว่าระบบสาธารณสุขจะรับได้ รวมทั้งยังมีการแพร่ระบาดต่อเนื่องเป็นเวลานาน บางประเทศสามารถควบคุมการระบาดของโรคได้ดี บางประเทศจำนวนผู้ติดเชื้อยังไม่ลดลงและกลับเพิ่มขึ้น บางประเทศที่ควบคุมการติดเชื้อได้จนไม่มีผู้ติดเชื้อในประเทศระยะหนึ่งก็กลับมาประสบกับการระบาดรอบสอง
โดยปกติแล้วการพัฒนาวัคซีนจะใช้เวลาเป็นปีตั้งแต่การวิจัย การทดสอบ และการทดลอง ก่อนที่จะนำไปใช้กับคน แต่กับโรคที่อุบัติใหม่ครั้งนี้ ในช่วง 6 เดือนที่ผ่านมา นักวิทยาศาสตร์ นักวิจัย และบริษัทยาหลายประเทศจำนวนมากได้เร่งแข่งกับเวลาเพื่อที่จะผลิตวัคซีนที่มีประสิทธิภาพและปลอดภัยออกใช้ภายในปีหน้า เนื่องจากยังมีผู้ติดเชื้อและผู้เสียชีวิตทั่วโลกเพิ่มขึ้นต่อเนื่อง
ณ วันที่ 1 สิงหาคม 2020 ข้อมูลจาก worldmeters ผู้ป่วยติดเชื้อสะสมทั่วโลกมีจำนวน 17,801,022 ราย เสียชีวิต 683,882 ราย รักษาหาย 11,190,486 ราย โดยสหรัฐฯ ยังเป็นประเทศที่มีการติดเชื้อสูงสุด 4,707,401 ราย เสียชีวิต 156,772 ราย รองลงมาคือบราซิล 2,666,298 ราย เสียชีวิต 92,568 ราย และอันดับสาม อินเดีย 1,706,391 ราย เสียชีวิต 36,662 ราย
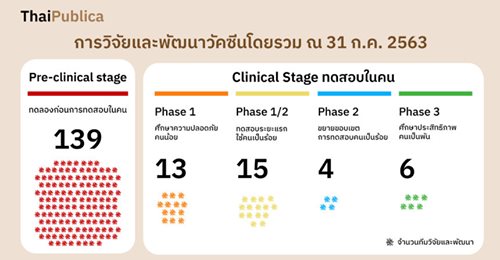
การพัฒนาวัคซีนเริ่มขึ้นในเดือนมกราคมเมื่อมีการระบุรหัสพันธุกรรมของไวรัสโคโรนาสายพันธุ์ใหม่ หรือ SARS-CoV-2 โดยจากข้อมูล องค์การอนามัยโลกหรือ WHO (World Health Organization) ณ วันที่ 31 กรกฎาคม 2020 พบว่า การพัฒนาวัคซีนที่อยู่ในขั้น preclinical evaluation หรือการทดลองก่อนที่จะทดสอบกับมนุษย์ มีจำนวน 139 ทีม และมี 26 ทีมที่พัฒนาในขั้นการทดลองกับมนุษย์
การทดลองวัคซีนในคนด้วยความปลอดภัยเริ่มขึ้นในเดือนมีนาคม แต่เส้นทางนี้ยังมีความไม่แน่นอนอีกมาก การทดลองในบางรายล้มเหลว มีเพียงไม่กี่รายที่ประสบความสำเร็จในการกระตุ้นระบบภูมิคุ้มกันให้สร้างแอนติบอดีที่มีประสิทธิภาพในการต้านไวรัส
หลายบริษัทเริ่มทดลองกับคนระยะ 3
การวิจัยและพัฒนาวัคซีนมีความคืบหน้ามาต่อเนื่อง โดย ณ วันที่ 31 กรกฎาคม 2563 มีบริษัทยาและสถาบันต่างๆ เริ่มการทดสอบวัคซีนกับคนในระยะที่ 3
รายแรกบริษัทโมเดอร์นา เทอราพิวติกส์ ได้เข้าสู่การทดสอบในคนระยะที่ 3 เมื่อวันที่ 27 กรกฎาคมที่ผ่านมา ซึ่งเป็นการศึกษาประสิทธิภาพ ที่ถือว่าเป็นระยะสำคัญที่จะได้คำตอบว่า วัคซีนที่มีชื่อว่า mRNA-1273 มีประสิทธิภาพในการป้องกันโควิด-19 หรือไม่
การทดลองในคนระยะที่ 3 จะมีอาสาสมัครทั้งสิ้น 30,000 คน ในศูนย์วิจัยราว 100 แห่งทั่วประเทศ โดยที่อาสาสมัครครึ่งหนึ่งจะได้รับวัคซีน อีกครึ่งหนึ่งจะได้วัคซีนหลอก (placebo) ซึ่งทั้งอาสาสมัครและนักวิจัยจะไม่มีใครรู้ว่า อาสาสมัครรายใดจะได้วัคซีนจริงหรือรายใดจะได้วัคซีนหลอก
โมเดอร์นา เทอราพิวติกส์ บริษัทเทคโนโลยีชีวภาพ ในรัฐแมสซาชูเซตส์ เป็นรายแรกที่ได้เริ่มต้นวิจัยและพัฒนาวัคซีนในคนมาตั้งแต่วันที่ 16 มีนาคม ด้วยความร่วมมือกับสถาบันโรคภูมิแพ้และโรคติดเชื้อแห่งชาติ (National Institute of Allergy and Infectious Diseases — NAIAD) ซึ่งสังกัดสถาบันสุขภาพแห่งชาติ (National Institutes of Health) ของสหรัฐฯ
การพัฒนาวัคซีนของโมเดอร์นาผลิตจาก liquid nanoparticle encapsulated-mRNA ใช้สารพันธุกรรมในการเริ่มต้นการสร้างวัคซีน แต่ยังไม่มีการผลิตออกมาในท้องตลาด
สำหรับรายต่อมาที่อยู่ในการทดลองกับคนระยะที่ 3 คือ สถาบันผลิตภัณฑ์ชีววิทยาอู่ฮั่น (Wuhan Institute of Biological Products) กักลุ่มเภสัชภัณฑ์แห่งชาติจีน (China National Pharmaceutical Group — Sinopharm) ซึ่งพัฒนาวัคซีนด้วยการใช้ไวรัสเชื้อตาย (inactivated) ได้รับเงินทุนสนับสนุนจากกระทรวงวิทยาศาสตร์และเทคโนโลยีของจีน
การทดลองวัคซีนระยะ 1/2 โดยมีเด็กอายุ 6 ปีขึ้นไป ได้สร้างการตอบสนองแอนติบอดีที่แข็งแกร่ง ส่วนการทดสอบระยะที่ 3 ในคนมีขึ้นที่สหรัฐอาหรับเอมิเรตส์ โดยอนุมัติให้ทดสอบในอาสาสมัครจำนวน 15,000 คน ที่มีอายุ 18-60 ปี
รายต่อมาคือ Sinovac พัฒนาวัคซีนชื่อว่า CoronaVac ซึ่งได้ผลการป้องกันบางส่วนและการป้องกันโดยสมบูรณ์ในลิง การทดสอบในหนูทั้งหนูตัวใหญ่ (Rat หนูตัวใหญ่ที่อยู่ตามท่อระบายน้ำ)และหนูตัวเล็ก (Mice) และสัตว์อื่นๆ สามารถทำให้แอนติบอดีมีค่าเป็นกลาง จากการใช้วัคซีนขนาด 3 ไมโครกรัม
ในการทดสอบระยะ 1/2 นั้นไม่ได้เกิดอาการที่ไม่พึงประสงค์ และมีการตอบสนองภูมิคุ้มกันในทางบวก ส่วนการทดสอบระยะที่ 3 กำลังมีขึ้นที่บราซิล ร่วมกับ Instituto Butantan และมีแผนที่จะใช้อาสาสมัตร 9,000 คนจากธุรกิจเฮลท์แคร์
บริษัทรายต่อมาคือ แอสตราเซเนกา (AstraZeneca) ร่วมกับมหาวิทยาลัยออกซฟอร์ด พัฒนาวัคซีนชื่อ AZD1222 ที่เปลี่ยนจาก ChAdOx1
ในการทดลองระยะ 1/2 ที่มีอาสาสมัครอายุ 18-55 ปีจำนวน 1,090 คนนั้น สองกลุ่มจะได้รับวัคซีนหรือวัคซีนป้องกันไข้กาฬหลังแอ่นเข็มเดียว กลุ่มที่สามได้วัคซีน AZD1222 และถูกกระตุ้นหลังจาก 4 สัปดาห์ ส่วนกลุ่มที่ 4 จะได้รับวัคซีนหรือ วัคซีนป้องกันไข้กาฬหลังแอ่นกับอะเซตามีโนเฟน (acetaminophen หรือยาพาราเซตามอล) ในปริมาณ 1 กรัมทุก 6 ชั่วโมงเป็นเวลา 24 ชั่วโมง
การทดสอบระยะที่ 3 จะมีขึ้นในอินเดียซึ่งร่วมกับ Serum Institute of India โดยใช้อาสาสมัครราว 30,000 คนซึ่งกำลังเปิดรับ ขณะที่รัฐบาลอินเดียได้เลือกสถานที่ไว้แล้ว 5 แห่ง
สำหรับบริษัทอื่นที่อยู่ในการทดลองกับคนระยะที่ 3 เช่นกัน ได้แก่ บริษัทไฟเซอร์ บริษัทยารายใหญ่ของสหรัฐและไบโอแอนด์เทค (BioNTech) บริษัทยาจากเยอรมนี ร่วมกันผลิตวัคซีนที่ชื่อว่า BNT162
การทดลองวัคซีนระยะ 1/2 ในเยอรมนีผ่านการอนุมัติจาก Paul-Ehrlich-Institut หลังจากทำการทดสอบในผู้ใหญ่ที่มีสุขภาพดี 200 คน ซีอีโอของไฟเซอร์คาดว่า น่าจะผลิตวัคซีนได้ในช่วงฤดูใบไม้ร่วงปี 2020 โดยวัคซีนที่น่าจะมีประสิทธิภาพสุดคือ BNT162b1
การทดสอบได้ให้วัคซีนในปริมาณที่แตกต่างกันคือ 10 ไมโครกรัม 30 ไมโครกรัม และ 100 ไมโครกรัม ซึ่งรายที่ได้รับวัคซีนในปริมาณสุงสุดเกิดอาการไม่พึงประสงค์ ดังนั้นจึงไม่ได้ให้วัคซีนโดสที่สอง ซึ่งนักวิจัยเชื่อว่าปริมาณที่เหมาะสมน่าจะอยู่ระหว่าง 10-30 ไมโครกรัม
วัคซีน BNT162b1 และ BNT162b2 ได้รับสถานะ fast track สำหรับการทดสอบจากสำนักงานอาหารและยา (FDA) ซึ่งซีอีโอคาดว่าวัคซีนจะพร้อมให้ FDA พิจารณาอนุมัติในสิ้นปี 2020
บริษัทแอสตราเซเนกาพัฒนาวัคซีนในรูปแบบการใช้เชื้อไวรัสเป็นพาหะตัวนำ (viral-vector vaccines) โดยเป็นไวรัสชนิดไม่แบ่งตัว (non-replicating viral vector)
ส่วนมหาวิทยาลัยเมลเบิร์นกับสถาบันวิจัยเด็กเมอร์ดอค (Murdoch Children’s Research Institute) และศูนย์แพทย์มหาวิทยาลัยรัดเบาด์ ฟอสต์แมน แล็บของโรงพยาบาลแมสซาชูเซตส์ เจเนอรัล ร่วมกันพัฒนาวัคซีนชื่อ Bacillus Calmette-Guerin หรือ BCG live-attenuated vaccine
จากรายงานในเดือนมีนาคม 2020 บ่งชี้ว่า ประเทศที่มีโครงการการฉีดวัคซีน BCG หรือวัคซีนป้องกันวัณโรคในเด็กๆ นั้นมีความสามารถในการต่อสู้กับการระบาดของไวรัสได้ดีกว่าประเทศที่ไม่มีโครงการการฉีดวัคซีนวัณโรคในเด็ก
ข้อมูลจาก WHO ระบุว่า วัคซีน BCG เป็นวัคซีนป้องกันวัณโรคในผู้ป่วยที่มีความเสี่ยงสูง และรู้จักกันดีว่าช่วยเสริมระบบภูมิคุ้มกันในการต่อสู้กับการติดเชื้อที่ใกล้เคียงกัน เช่น โรคเรื้อน โรคผิวหนังเป็นแผลที่เกิดจากเชื้อแบคทีเรีย
การทดลองในระยะที่ 3 ของกลุ่มนี้มีขึ้นที่ออสเตรเลียและเนเธอร์แลนด์ ซึ่งอยู่ระหว่างรับอาสาสมัครเพื่อประเมินว่าวัคซีน BCG มีผลกระทบความสามารถของบุคคลากรทางด้านการดูแลสุขภาพในการป้องกันไวรัสอย่างไร โดยโรงพยาบาลแมสซาชูเซตส์เจเนอรัลกำลังประเมินผลของ BCG ต่อโรคโรคเบาหวานชนิดที่ 1 และกำลังหาทุนเพื่อประเมินผลที่มีต่องโควิด-19 ในกลุ่มบุคลากรทางด้านสุขภาพ
ด้านจอห์นสันแอนด์จอห์นสัน ประกาศเมื่อวันที่ 27 กรกฎาคมที่ผ่านมาว่า ได้เริ่มการทดลองในคนเป็นครั้งแรก
สำนักงานคณะกรรมการอาหารและยาของสหรัฐฯ (Food and Drug Administration — FDA) ระบุว่า วัคซีนที่จะได้รับการอนุมัติจะต้องป้องกันหรือระงับอาการที่รุนแรงของโรคในผู้ที่ได้รับวัคซีนได้ถึง 50%
ในเอเชียประเทศที่มีความคืบหน้าในการพัฒนาวัคซีนคือ สิงคโปร์ โดยบริษัทอาร์กทูรัส เธราพิวติกส์ โฮลดิ้งส์ อิ้งค์(Arcturus Therapeutics Holdings Inc) ผู้นำด้านการทดสอบ mRNA ทางคลินิก ที่มุ่งเน้นไปที่การค้นพบ การพัฒนาและการจำหน่ายยารักษาโรคที่พบได้น้อยและวัคซีน และโรงเรียนแพทย์ดุ๊ก-เอ็นยูเอส( Duke-NUS Medical School) ที่เน้นการวิจัยระดับแนวหน้าของสิงคโปร์ ประกาศว่า การยื่นขอการทดลองทางคลินิกวัคซีน LUNAR-COV19 ต้านไวรัสโควิด-19 ได้รับการอนุมัติให้ดำเนินการโดยหน่วยงานด้านวิทยาศาสตร์สุขภาพของสิงคโปร์
Arcturus และ Duke-NUS ร่วมมือกันพัฒนาวัคซีนต้านไวรัสโคโรนาโดยใช้เทคโนโลยีสตารร์(STARR) ของ Arcturus และแพลตฟอร์มที่เป็นเอกลักษณ์ที่พัฒนาขึ้นที่ Duke-NUS ซึ่งช่วยให้สามารถคัดกรองวัคซีนได้อย่างรวดเร็วเพื่อให้มีประสิทธิภาพและความปลอดภัย
Arcturus และ Duke-NUS จะเริ่มต้นการฉีดวัคซีน LUNAR-COV19 ในมนุษย์โดยเร็วที่สุด การทดลองกับอาสาสมัครที่มีสุขภาพดีจะประเมินระดับปริมาณ LUNAR-COV19 ในหลายระดับในผู้ใหญ่ที่มีจำนวนมากถึง 108 คนรวมถึงผู้สูงอายุ และจะมีการติดตามเพื่อประเมินความปลอดภัย การยอมรับตัวยา รวมทั้งขอบเขตและระยะเวลาของการตอบสนองทางภูมิคุ้มกันของร่างกายและเซลล์
แพลตฟอร์มเทคโนโลยี STARR ที่ใช้ในการพัฒนา LUNAR-COV19 ได้ผนวก mRNA ที่แบ่งตัวได้กับ LUNAR ซึ่งเป็นระบบการจัดส่งอนุภาคนาโนซึ่งปรับให้เหมาะกับโมเลกุล mRNA
ประสิทธิภาพและลักษณะการแบ่งตัวเองของ mRNA ถูกออกแบบมาเพื่อให้ใช้วัคซีนในปริมาณที่ต่ำมากและมีศักยภาพในครั้งเดียว ข้อมูลจากการทดลองในสัตว์ก่อนหน้านี้ แสดงให้เห็นถึงการสร้างภูมิคุ้มกันของร่างกายและเซลล์อย่างมีประสิทธิภาพในการใช้ LUNAR-COV19 ปริมาณต่ำเพียง 0.2 ไมโครกรัม นอกจากนี้ Arcturus ยังแสดงให้เห็นถึงการสร้างภูมิคุ้มกันได้ 100% มีค่าแอนติบอดีเป็นกลางจากการใช้ปริมาณที่ต่ำมากเพียงครั้งเดียว (2.0 ไมโครกรัม)
ข้อมูลจากการทดลองขั้นล่าสุด แสดงให้เห็นว่าการปรับระดับแอนติบอดี้ให้เป็นกลางเพื่อตอบสนองต่อการใช้ LUNAR-COV19 เพียงครั้งเดียว (0.2, 2.0, 10.0 ไมโครกรัม) ยังคงเพิ่มขึ้นต่อเนื่องกว่า 50 วัน
ขั้นตอนการวิจัยค้นคว้าวัคซีน
แม้โมเดอร์นามีการพัฒนาที่คืบหน้ากว่ารายอื่น แต่ก็ไม่ได้หมายความว่าโมเดอร์นาจะเป็นรายเดียวที่ประสบความสำเร็จ เพราะบริษัทยาทุกรายต้องผลิตวัคซีนที่มีประสิทธิภาพและปลอดภัย และเช่นเดียวกันวัคซีนป้องกันไข้หวัด วัคซีนบางตัวอาจได้ผลกับคนบางกลุ่ม เช่น ผู้สูงวัย หรือผู้ที่มีระบบภูมิคุ้มกันที่เข้ากันได้ ดังนั้นนี่คือเหตุผลสำคัญว่าทำไมการทดสอบในคนระยะที่ 3 จึงต้องใช้คนจำนวนมากและจากหลากหลายกลุ่ม
โดยทั่วไปการวิจัยพัฒนาวัคซีนใหม่ๆ ต้องผ่านหลายขั้นตอน ทั้งการวิจัย ทดสอบประสิทธิภาพ และความปลอดภัย เป็นการทดลองก่อนการทดสอบในมนุษย์ ที่เริ่มจากเครื่องมือในห้องปฏิบัติการ เมื่อได้ผลก็ต้องมีการทดสอบในสัตว์ ซึ่งนักวิจัยจะให้วัคซีนกับสัตว์เพื่อดูว่าสามารถสร้างการตอบสนองของภูมิคุ้มกันหรือไม่ หากทดลองจนได้ผลที่น่าพอใจ ก็จะนำมาผ่านกระบวนการศึกษาวิจัยในคนว่ามีความเหมาะสม และปลอดภัยหรือไม่ ซึ่งตามมาตรฐานสากลกำหนดการวิจัยในคนเป็น 3 ระยะ ดังต่อไปนี้
ระยะที่ 1 ศึกษาความปลอดภัย (safety trials) ขั้นตอนนี้เป็นการให้วัคซีนแก่อาสาสมัครที่มีจำนวนไม่มากนัก เพื่อทดสอบความปลอดภัยและปริมาณวัคซีนที่ใช้ ซึ่งต้องติดตามอาสาสมัครอย่างใกล้ชิดเพื่อดูว่ากระตุ้นระบบภูมิคุ้มกันหรือไม่
ระยะที่ 2 ขยายขอบเขตการทดสอบ (expanded trails) นักวิทยาศาสตร์จะให้ยากับอาสาสมัครในจำนวนที่มากขึ้นเป็นหลายร้อยคน และแบ่งออกเป็นกลุ่ม เช่น กลุ่มเด็กและกลุ่มผู้สูงอายุ เพื่อดูว่าวัคซีนมีผลต่อแต่ละกลุ่มอย่างไร ในขั้นตอนนี้มีการทดสอบความปลอดภัยและประสิทธิภาพของวัคซีนในการกระตุ้นระบบภูมิคุ้มกันด้วย ในเดือนมิถุนายนสำนักงานคณะกรรมการอาหารและยาระบุว่าวัคซีนต้องป้องกันอาสาสมัครที่เข้าร่วมได้ถึง 50% จึงจะถือว่ามีประสิทธิภาพ
ระยะที่ 3 ศึกษาประสิทธิภาพ (efficacy trials) นักวิยาศาสตร์จะให้วัคซีนกับอาสาสมัครในจำนวนที่มากขึ้นในระดับพันคนขึ้นไป และรอผลว่ามีกี่รายที่ติดเชื้อ เมื่อเทียบกับรายที่ได้รับวัคซีนหลอก การทดสอบระยะนี้เป็นการตัดสินว่าวัคซีนป้องกันไวรัสได้หรือไม่
การอนุมัติ ทางการในแต่ละประเทศจะตรวจสอบผลการทดสอบและพิจารณาว่าจะอนุมัติให้ใช้วัคซีนนั้นหรือไม่ ในระหว่างการระบาดของไวรัส วัคซีนอาจจะได้รับอนุญาตให้ใช้เป็นกรณีฉุกเฉินก่อนที่จะได้รับอนุญาตอย่างเป็นทางการต่อไป
ปฏิบัติการ Warp Speed การพัฒนาวัคซีนภายใต้โครงการ Operation Warp Speed หรือปฏิบัติการเร่งด่วนของรัฐบาลสหรัฐฯ คาดว่าจะประกาศชื่อโครงการไม่ต่ำกว่า 5 รายที่จะได้รับเงินจากรัฐสนับสนุนการพัฒนาวัคซีนก่อนที่จะได้ผลการทดสอบว่ามีประสิทธิภาพจริง
รวมระยะทดสอบ (combined phases) อีกหนทางหนึ่งที่เร่งการพัฒนาวัคซีน คือการรวมระยะการทดสอบเข้าด้วยกัน การพัฒนาวัคซีนบางรายอยู่ในระยะที่ 1/2 เช่น การทดสอบระยะแรกแต่ใช้อาสาสมัครจำนวนนับร้อย
รูปแบบการพัฒนาวัคซีน
เว็บไซต์ nature.com ได้ให้ข้อมูลรูปแบบการพัฒนาวัคซีนด้วยอินโฟกราฟิก เริ่มจากการอธิบายกระบวนการสร้างภูมิคุ้มกันในร่างกายคน
โดยปกติร่างกายคนมีระบบภูมิคุ้มกันที่สามารถตรวจจับเชื้อโรคตัวใหม่ที่เข้าสู่ร่างกาย ดังนั้นเมื่อไวรัสโคโรนาสายพันธุ์ใหม่ หรือ SARS-CoV-2 ซึ่งเป็นไวรัสมีผิวโปรตีน ที่เรียกว่า สไปก์โปรตีน (spike protein) เข้ามาในร่างก สไปก์โปรตีนจะจับกับตัวรับที่ชื่อว่า angiotensin-converting enzyme 2 (ACE2 receptor) ที่อยู่บนผิวเซลล์ในร่างกาย หลังจากที่ไวรัสเข้าสู่เซลล์ ก็จะสร้าง RNA ชิ้นส่วนโปรตีนและก่อตัวเป็นไวรัสตัวใหม่ และปล่อยออกมาเพื่อไปจับอวัยวะอื่น
เมื่อไวรัสที่จัดว่าเป็นแอนติเจน (antigen) ซึ่งเป็นสารแปลกปลอมเข้าสู่ร่างกาย เม็ดเลือดขาวก็จะเข้ามาจัดการกับแอนติเจน และเปลี่ยนเป็น antigen presenting cell (APC) ส่งสัญญาณกระตุ้นเซลล์เม็ดเลือดขาวชนิด T-helper ทำหน้าที่สร้างภูมิคุ้มกันและกระตุ้น B cell ที่สัมผัส antigen เดียวกันให้ทำหน้าที่ผลิตภูมิคุ้มกันแล้วทำลาย
B cell ส่วนหนึ่งยังมีการเปลี่ยนไปเป็น memory B cells เก็บความจำ เมื่อได้รับแอนติเจนตัวเดิมอีก memory B cells และ T-cell ที่จำไวรัสได้ ก็เฝ้าระวังให้กับร่างกายได้นานเป็นเดือนหรือเป็นปี และสร้างภูมิคุ้มกันได้เร็วกว่าและมีประสิทธิภาพมากกว่าครั้งแรก
ทั้งหมดนี้เป็นกระบวนการสร้างภูมิคุ้มกันของมนุษย์ และเป็นหลักการของการให้วัคซีน เพราะวัคซีนทุกชนิดมีเป้าหมายที่จะเปิดโอกาสให้ร่างกายสัมผัสกับแอนติเจนที่ไม่ก่อให้เกิดโรค แต่จะกระตุ้นการตอบสนองของระบบภูมิคุ้มกันที่สามารถป้องกันหรือฆ่าไวรัสหากบุคคลนั้นติดเชื้อ
ปัจุบันมีการพัฒนาวัคซีนต้านโควิด-19 อย่างน้อย 8 ชนิด และแต่ละชนิดก็ใช้สารตั้งต้นที่แตกต่างกัน มีทั้งการใช้ไวรัสหรือส่วนหนึ่งของไวรัส
วัคซีนจากไวรัส หรือ Virus Vaccines
ขณะนี้มีอย่างน้อย 7 ทีมที่พัฒนาวัคซีนจากไวรัส ทั้งการทำให้เชื้อไวรัสอ่อนแรง (weakened virus) หรือหมดฤทธิ์ด้วยสารเคมี (inactivated virus) ซึ่งหลายวัคซีนที่ใช้กันแพร่หลายในขณะนี้ก็พัฒนาจากแนวทางนี้ เช่น วัคซีนโรคหัด วัคซีนป้องกันโปลิโอ แต่ต้องมีการทดสอบความปลอดภัยให้รอบด้าน
ชนิด Weakened virus
ไวรัสถูกทำให้อ่อนลงตามวัคซีนโดยการผ่านสัตว์หรือเซลล์มนุษย์ จนกระทั่งเซลล์ยอมรับการกลายพันธุ์ที่ทำให้ไม่สามารถทำให้เกิดโรคได้ซึ่ง Codageniz จากฟาร์มิงเดล รัฐนิวยอร์ก กำลังร่วมมือกับสถาบันเซรุ่มของอินเดีย ผู้ผลิตในปูเน่ ได้ทำให้ไวรัสโควิดอ่อนตัวลงด้วยการเปลี่ยนรหัสพันธุกรรมเพื่อให้โปรตีนไวรัสผลิตได้อย่างมีประสิทธิภาพน้อย
ชนิด Inactivated Virus
ในวัคซีนเหล่านี้ไวรัสจะไม่ติดเชื้อด้วยการใช้สารเคมี เช่น ฟอร์มาลดีไฮด์ หรือการใช้ความร้อน แต่การทำวัคซีนชนิดนี้ต้องใช้ไวรัสที่ไม่ติดเชื้อจำนวนมาก
การใช้เชื้อตัวนำ (Viral-Vector Vaccines)
ปัจจุบันมีประมาณ 25 ทีมที่กำลังพัฒนาวัคซีนโดยใช้เชื้อเป็นตัวนำหรือพาหะไวรัส เช่น หัด หรืออะดีโนไวรัส ที่ถูกดัดแปลงพันธุกรรมเพื่อให้สามารถผลิตโปรตีนไวรัสโคโรนาในร่างกายแทนการใช้เชื้อไวรัสโคโรนาโดยตรง ไวรัสเหล่านี้อ่อนแอลง ดังนั้นจึงไม่สามารถทำให้เกิดโรคได้ การพัฒนาวัคซีนแบบนี้มี 2 ชนิด คือ
ชนิดแบ่งตัว (replicating viral vector) เช่น ไวรัสโรคหัดที่ทำให้อ่อนแอลง วัคซีนอีโบลาที่เพิ่งได้รับการอนุมัติ เป็นตัวอย่างของการพัฒนาวัคซีนแบบใช้เชื้อเป็นตัวนำที่สามารถแบ่งตัวได้ภายใน วัคซีนดังกล่าวมีแนวโน้มที่จะปลอดภัยและกระตุ้นการตอบสนองภูมิคุ้มกันที่แข็งแกร่ง อย่างไรก็ตาม ภูมิคุ้มกันที่มีอยู่กับตัวนำอาจจะทำให้ประสิทธิภาพวัคซีนลดลงได้
ชนิดไม่แบ่งตัว (non-replicating viral vector) เช่น ไวรัสอะดีโน ไม่มีวัคซีนที่ได้รับใบอนุญาตให้ใช้วิธีนี้ แต่มีประวัติยาวนานในการรักษาด้วยยีน เพื่อสร้างภูมิคุ้มกันที่ยั่งยืนจำเป็นต้องมีการฉีดกระตุ้น บริษัทจอห์นสันแอนด์จอห์นสัน ผู้ผลิตยารายใหญ่กำลังพัฒนาในแนวทางนี้
วัคซีนแบบใช้กรดนิวคลีอิก Nucleic-Acid Vaccines
ปัจจุบันอย่างน้อย 20 ทีมมีเป้าหมายที่อย่างน้อย 20 ทีมมีเป้าหมายที่จะใช้คำสั่งทางพันธุกรรม (ในรูปแบบของ DNA หรือ RNA) สำหรับโปรตีนไวรัสโคโรนาที่ทำให้เกิดการตอบสนองของระบบภูมิคุ้มกันในทันที กรดนิวคลีอิกจะถูกฉีดเข้าไปในร่างกาย จากนั้น ร่างกายจะสร้างชิ้นส่วนโปรตีนของเชื้อไวรัสในร่างกาย ซึ่งจะกระตุ้นระบบภูมิคุ้มกัน
วัคซีน DNA การนำดีเอ็นเอเข้าสู่เซลล์ ด้วยกระบวนการที่เรียกว่า electroporation หรือ การใช้ไฟฟ้าแรงสูงที่มีความต่างศักย์สูงๆ กระตุ้นให้เยื่อหุ้มเซลล์จะถูกเปิดเป็นรู เพิ่มการดูดซึมของดีเอ็นเอเข้าสู่เซลล์
วัคซีน RNA อาร์เอ็นเอมักจะถูกห่อหุ้มด้วยชั้นไขมันเพื่อให้สามารถเข้าสู่เซลล์
วัคซีนที่ใช้ RNA และ DNA นั้นปลอดภัยและง่ายต่อการพัฒนา การผลิตวัคซีนนั้นเกี่ยวข้องกับการสร้างสารพันธุกรรมเท่านั้นไม่ใช่ไวรัส แต่ก็ไม่ได้รับการพิสูจน์ ไม่มีวัคซีนที่มีใบอนุญาตใช้เทคโนโลยีนี้
วัคซีนแบบใช้โปรตีน Protein-based Vaccines
นักวิจัยจำนวนต้องการที่จะฉีดโปรตีนของเชื้อไวรัสโคโรนาเข้าในร่างกายโดยตรง อาจใช้ชิ้นส่วนของโปรตีนส่วนที่เรียกว่าสไปก์โปรตีน หรือโปรตีนที่ทำเลียนผิวด้านนอกของไวรัสโคโรนาก็ได้
Protein Subunits ปัจจุบันมี 28 ทีมกำลังพัฒนาวัคซีนที่ใช่หน่วยย่อยโปรตีน ส่วนใหญ่มุ่งเน้นไปที่ spike protein หรือส่วนสำคัญของมันที่เรียกว่า receptor-binding domain (RBD) คือรูปร่างของลิแกนด์และตัวรับบนเซลล์ของโฮสต์ วัคซีนที่คล้ายกันคือ วัคซีนไวรัสโรคซาร์สป้องกันลิงจากการติดเชื้อ แต่ไม่ได้รับการทดสอบในคน
ในการพัฒนาวัคซีนเหล่านี้อาจต้องใช้สารที่เข้าสู่ร่างกายร่วมกับแอนติเจน ซึ่งเป็นโมเลกุลที่กระตุ้นภูมิคุ้มกันพร้อมกับวัคซีน และต้องฉีดหลายครั้ง
Virus-like Particles ผิวไวรัสที่เลียนแบบโครงสร้างของไวรัสโคโรนาแต่ไม่ติดเชื้อ เพราะขาดสารพันธุกรรม ขณะนี้มี 5 ทีมกำลังพัฒนาวัคซีนด้วยการนำโครงสร้างมาทำเป็นผิวของไวรัส ซึ่งสามารถกระตุ้นการตอบสนองของระบบภูมิคุ้มกันที่แข็งแกร่ง แต่อาจสร้างได้ยาก
กว่า 70% ของกลุ่มผู้นำด้านการวิจัยวัคซีนนั้นมาจากบริษัทอุตสาหกรรมหรือบริษัทเอกชน การทดลองทางคลินิกเริ่มจากการศึกษาความปลอดภัยที่น้อยในสัตว์และคน ตามด้วยการทดลองขนาดใหญ่ เพื่อตรวจสอบว่าวัคซีนสร้างภูมิคุ้มกันตอบสนองหรือไม่ นักวิจัยกำลังเร่งขั้นตอนเหล่านี้และหวังว่าจะมีวัคซีนพร้อมใน 18 เดือน
Source: ThaiPublica
------------------------------------------------------
Cr.Bank of Thailand Scholarship Students
เพิ่มเพื่อนรับข่าวสารตลาดหุ้น Forex และบทความดีๆ ด้านการเงิน การลงทุน ฟรี !!
http://line.me/ti/p/%40zhq5011b
Line ID:@fxhanuman
Web : https://www.fxhanuman.com
Web : https://www.eluforex.com/
FB:https://www.facebook.com/review.forex.broker/
เยี่ยมชม partner ของเราที่ Eluforex รีวิวโบรกเกอร์ Forex
#forex #ลงทุน #peppers #xm #fbs #exness #uag #icmarkets #avatrade #fxtm #tickmill #fxpro #fxopen #fxcl #forex3d #forex4you